Lääkinnällisten laitteiden ohjelmistokehitys
Lääkinnällisen laitteen ohjelmistokehitys on tarkkaan säädeltyä aina suunnitteluvaiheesta valmiiseen ja hyväksyttyyn ohjelmistoon asti. Tärkeässä roolissa koko prosessin ajan ovat alan laatuvaatimusten tuntemus ja huolellinen toiminta, jotta ihmisten terveys ja turvallisuus voidaan varmistaa.
Olemme erikoistuneet huippuluokan ohjelmistopalveluihin ja ratkaisuihin, jotka täyttävät lääkinnällisten laitteiden tiukat vaatimukset.

Ratkaisumme
FHIRWORX
Haluatko tehostaa terveydenhuolto-organisaatiosi toimintaa? Vaikuttavatko tietojärjestelmien integraatiot liian monimutkaisilta? FHIRWORX-palvelumme auttaa integroitumaan potilastietojärjestelmiin, ottamaan käyttöön tekoälyn ja analytiikan sekä keräämään kaikki tarvitsemasi olennaiset tiedot yhteen.
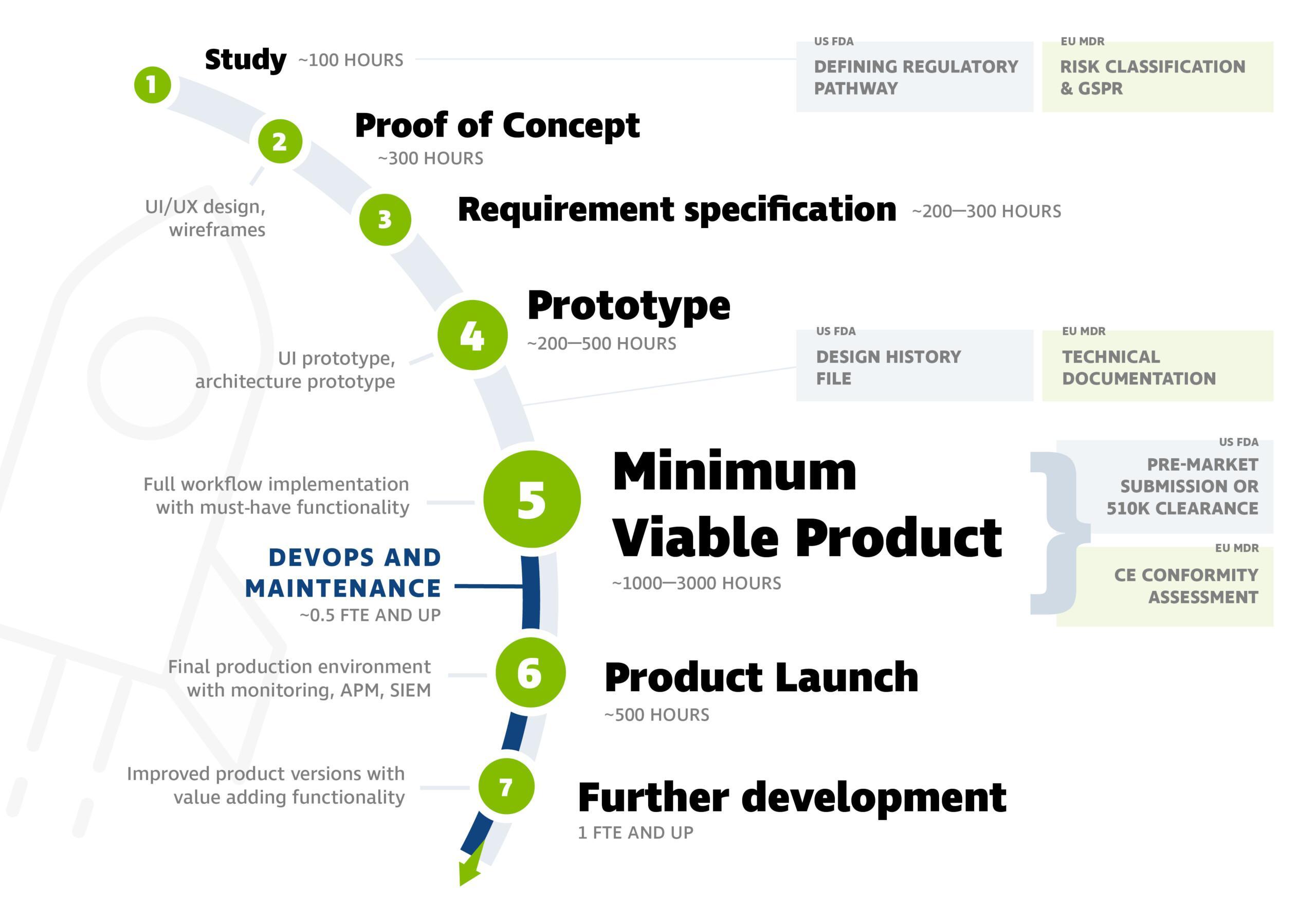
Ohjelmistokehityksen vaiheet
Lääkinnällisten laitteiden ohjelmistokehitysprosessi etenee tyypillisesti alla olevien vaiheiden mukaisesti. Näet kuvasta esimerkinomaiset työmääräarviot.
Kuva sisältää vaiheet alusta alkaen, mutta projekti voidaan käynnistää myös myöhemmissä vaiheissa. Usein tuote on valmis markkinoille vaiheessa 5 (Minimum Viable Product).
Takuu
Tarjoamme lääkinnällisten laitteiden ohjelmistokehityksen palveluita. Meille on myönnetty lääkinnällisten laitteiden ja ohjelmistojen ISO 13485 -sertifikaatti, joka koskee asiakkaille tehtävää lääkinnällisten ohjelmistojen kehitystyötä. Annamme takuun, että teemme työmme regulaation vaatimusten mukaisesti.

Regulaatiot
- EU Medical Device Regulation (EU MDR) – CE marking
- US FDA Medical Device Regulation
Standardit
- ISO 13485 – Quality Management
- IEC 62304 – Software Lifecycle
- ISO 14971 – Risk Management
- IEC 62366 – Usability
Teknologia: integraatiot ja alustaratkaisut
Tiedon saumaton kulku on lääketieteen alalla erityisen tärkeää. Me varmistamme, että käyttämäsi järjestelmät sopivat yhteen ja toteutamme tarvittavat ratkaisut. Tunnemme tiedonsiirron standardit ja tekniikat kuten HL7 CDA R2, FHIR, DICOM, XDS.
Skaalautuva tuotantoympäristö voidaan toteuttaa esimerkiksi julkisten pilvialustojen avulla. Olemme toteuttaneet useille asiakkaillemme pilvialustoihin perustuvia sovelluksia ja ratkaisuja. Eniten käyttämämme alustat ovat Microsoft Azure ja Amazon AWS.
Lue lisää
Lääkinnällisten ohjelmistojen testaaminen ISO 13485 -standardin mukaisesti – ota huomioon nämä viisi asiaa
White paperissa kerromme lisää lääkinnällisten ohjelmistojen testauksesta ISO 13485 -standardin mukaisesti. Nostamme esiin viisi asiaa, jotka tulee ottaa huomioon, kun lääkinnällisten ohjelmistojen testausta suunnitellaan ja toteutetaan. Lue lisää!


Lääkinnällisen laitteen käytettävyyssuunnittelu
Lääkinnällisten laitteiden käytettävyysstandardin ensisijaisena tavoitteena on potilasturvallisuuden varmistaminen. Jotta käytettävyys tulee huomioitua lääkinnällisen laitteen kehitysprosessissa heti alusta alkaen, kannattaa valmistajan hyödyntää IEC 62366 -standardia. Avaamme IEC 62366-1 -standardin mukaista käytettävyyden kehitysprosessia tarkemmin white paperissamme, lue lisää!
Juho Leppämäki
Myynti, lääkinnälliset laitteet
Laatupäällikkö
juho.leppamaki@atostek.com
+358 45 113 8883